آزئوتروپیک آزئوتروپ (به انگلیسی: Azeotrope) در اصطلاح ترمودینامیک شیمیایی به مخلوطهایی گفته میشود.
که با تقطیر ساده قابل جداسازی نباشند.
قانون رائولت در شرایط تعادل مایع-بخار و برای یک محلول ایده ال بیان میکند که فشار یک بخار وابسته است به ترکیبات شیمیایی آنها و تجزیه مولی ذراتش.
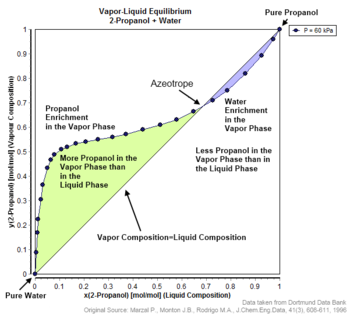
در نتیجه فشار بخار با کسر مولی ذرات رابطهای خطی خواهد داشت. اما در مخلوطهای آزئوتروپ این رابطه از فرم خطی خارج میشود.
انحراف منفی:
در این حالت نمودار دما-کسر مولی در فشار ثابت دارای مینیم و نمودار فشار-کسر مولی در دما ثابت دارای ماکسیمم است. این حالت نشانگر غلبه نیروهای بین مولکولهای غیر مشابه بر نیروی بین مولکولهای مشابه است.
انحراف مثبت:
در این حالت نمودار دما-کسر مولی در فشار ثابت دارای ماکسیمم و نمودار فشار-کسر مولی در دما ثابت دارای مینیمم است. این حالت نشانگر غلبه نیروهای بین مولکولهای مشابه بر نیروی بین مولکولهای غیر مشابه است.
یک آزئوتروپ یا یک مخلوط نقطه حرارت ثابت مخلوطی از دو یا چند مایع است که نسبت آنها با تقطیر ساده قابل تغییر یا تغییر نیست.
این به این دلیل اتفاق میافتد که وقتی یک آزئوتروپ جوشانده میشود، بخار دارای نسبتهای ترکیبی مشابه مخلوط جوشنخورده است. از آنجا که ترکیب آنها با تقطیر تغییر نمی کند، آزئوتروپ ها را (به ویژه در متون قدیمی تر) مخلوط های نقطه جوش ثابت نیز می نامند.
برخی از مخلوطهای آزئوتروپیک از جفتهای ترکیبات شناخته شدهاند، و بسیاری از آزئوتروپهای سه یا چند ترکیب نیز شناخته شدهاند.
در چنین حالتی امکان جداسازی اجزا با تقطیر جزئی وجود ندارد و معمولاً به جای آن از تقطیر آزئوتروپیک استفاده می شود. دو نوع آزئوتروپ وجود دارد: آزئوتروپ حداقل جوش و آزئوتروپ حداکثر جوش. محلولی که انحراف مثبت بیشتری از قانون رائول نشان میدهد، حداقل آزئوتروپ جوشش را در یک ترکیب خاص تشکیل میدهد.
به عنوان مثال، مخلوط اتانول-آب (به دست آمده از تخمیر قندها) در تقطیر جزئی، محلولی حاوی حداکثر ۹۵٪ (حجمی) اتانول به دست می دهد. هنگامی که این ترکیب به دست آمد، مایع و بخار ترکیب یکسانی دارند و جدایی بیشتر رخ نمی دهد. محلولی که انحراف منفی زیادی از قانون رائول نشان میدهد، یک آزئوتروپ جوشش حداکثر در یک ترکیب خاص را تشکیل میدهد. اسید نیتریک و آب نمونه ای از این دسته از آزئوتروپ ها هستند. این آزئوتروپ دارای ترکیب تقریبی ۶۸٪ اسید نیتریک و ۳۲٪ آب بر وزن، با نقطه جوش ۳۹۳.۵ K (120.4 درجه سانتیگراد) است.
علم اشتقاق لغات
واژه آزئوتروپ از کلمات یونانی ζέειν (جوش) و τρόπος (چرخش) با پیشوند α- (no) گرفته شده است تا معنای کلی “بدون تغییر در جوشیدن” را بدهد. این اصطلاح در سال ۱۹۱۱ توسط شیمیدان انگلیسی جان وید و ریچارد ویلیام مریمن ابداع شد.
- انواع
آزئوتروپ های مثبت و منفی - آزئوتروپ مثبت – مخلوطی از کلروفرم و متانول
- آزئوتروپ منفی – مخلوطی از اسید فرمیک و آب
هر آزئوتروپ نقطه جوش مشخصی دارد. نقطه جوش یک آزئوتروپ یا کمتر از دمای نقطه جوش هر یک از اجزای تشکیل دهنده آن است (یک آزئوتروپ مثبت)، یا بیشتر از نقطه جوش هر یک از اجزای تشکیل دهنده آن (آزئوتروپ منفی).
ساخت نمودار p-v-x مناسب برای یک آزئوتروپ
نمونه معروف آزئوتروپ مثبت ۹۵.۶۳% اتانول و ۴.۳۷% آب (بر حسب جرم) است که در ۷۸.۲ درجه سانتیگراد می جوشد. اتانول در ۷۸.۴ درجه سانتیگراد، آب در ۱۰۰ درجه سانتیگراد میجوشد، اما آزئوتروپ در دمای ۷۸.۲ درجه سانتیگراد میجوشد که کمتر از هر یک از اجزای تشکیل دهنده آن است. در واقع، ۷۸.۲ درجه سانتی گراد حداقل دمایی است که در آن هر محلول اتانول/آب می تواند در فشار اتمسفر بجوشد. به طور کلی، یک آزئوتروپ مثبت در دمای کمتری نسبت به سایر نسبتهای تشکیلدهندهاش میجوشد. آزئوتروپ های مثبت را مخلوط های حداقل جوش یا آزئوتروپ های حداکثر فشار نیز می نامند.
به طور کلی، یک آزئوتروپ منفی در دمای بالاتری نسبت به سایر نسبتهای تشکیلدهندهاش میجوشد. آزئوتروپ های منفی را مخلوط های حداکثر جوش یا آزئوتروپ های حداقل فشار نیز می نامند. نمونه ای از آزئوتروپ منفی، اسید کلریدریک با غلظت ۲۰.۲ درصد و ۷۹.۸ درصد آب (بر حسب جرم) است. کلرید هیدروژن در ۸۴- درجه سانتیگراد و آب در ۱۰۰ درجه سانتیگراد می جوشد، اما آزئوتروپ در دمای ۱۱۰ درجه سانتیگراد می جوشد که بالاتر از هر یک از اجزای تشکیل دهنده آن است. حداکثر دمایی که هر محلول اسید هیدروکلریک می تواند در آن بجوشد ۱۱۰ درجه سانتی گراد است. نمونه های دیگر:
- اسید هیدروفلوئوریک (۳۵.۶٪) / آب، در ۱۱۱.۳۵ درجه سانتیگراد می جوشد
- اسید نیتریک (۶۸٪) / آب، در ۱۲۰.۲ درجه سانتیگراد در ۱ atm می جوشد
- اسید پرکلریک (۷۱.۶٪) / آب، در ۲۰۳ درجه سانتیگراد می جوشد
- اسید سولفوریک (۹۸.۳٪) / آب، در دمای ۳۳۸ درجه سانتیگراد می جوشد
آزئوتروپ های همگن و ناهمگن
اگر اجزای یک مخلوط کاملاً با همه نسبت ها با یکدیگر امتزاج شوند، به نوع آزئوتروپ، آزئوتروپ همگن می گویند. به عنوان مثال، هر مقدار اتانول را می توان با هر مقدار آب مخلوط کرد تا یک محلول همگن تشکیل شود.
نمودار فاز یک هترو آزئوتروپیک محور عمودی دما و محور افقی ترکیب است. هر زمان که هر دو لایه در مخلوط اصلی وجود داشته باشند، خط عمودی نقطهدار ترکیب لایههای ترکیبی تقطیر را نشان میدهد.
اگر اجزای تشکیل دهنده کاملاً قابل امتزاج نباشند، می توان یک آزئوتروپ را در داخل شکاف امتزاج پذیری یافت. به این نوع آزئوتروپ، آزئوتروپ ناهمگن یا هتروآزئوتروپ می گویند. تقطیر هتروآزئوتروپیک دو فاز مایع خواهد داشت. به عنوان مثال، استون / متانول / کلروفرم یک آزئوتروپ جوشان متوسط (زینی) را تشکیل می دهد.
به عنوان مثال، اگر حجم های مساوی از کلروفرم (حلالیت در آب ۰.۸ گرم در ۱۰۰ میلی لیتر در ۲۰ درجه سانتی گراد) و آب با هم تکان داده شود و سپس بماند، مایع به دو لایه جدا می شود. تجزیه و تحلیل لایهها نشان میدهد که لایه رویی عمدتاً آب با مقدار کمی کلروفرم محلول در آن است و لایه زیرین عمدتاً کلروفرم است که مقدار کمی آب در آن حل شده است.